Asitler, Bazlar ve Tuzlar
Arrhenius'a göre asit baz tanımı nasıldır?
Arrhenius'a göre sulu çözeltisinde hidroksit (OH–) iyonu oluşturan maddeleri baz, hidrojen (H+) iyonu oluşturan maddeleri asit olarak tanımlamıştır.
Brønstead ve Lowry'e göre asit baz tanımı nasıldır?
Brønstead ve Lowry tarafından asit ve bazlar için daha genel bir tanım önerilmiştir. Bu tanım; asit-baz tepkimelerinde, bir maddeden diğerine proton (H+) aktarılmasına dayanır. Buna göre tepkimede proton veren maddeye asit, proton alan maddeye baz denir.
Arrhenius ile Brønsted-Lowry asit-baz tanımı arasındaki fark nedir?
Arrhenius asit-baz tanımı sadece sulu çözeltiler için geçerli iken, Brønsted-Lowry asit-baz tanımı hem sulu hemde susuz çözeltiler için geçerlidir.
Amfoter bileşik nedir?
Bir bileşik farklı bileşiklere karşı hem asit hem de baz gibi davranabiliyorsa amfoter (amfiprotik) bileşik olarak adlandırılır.
Lewis asit baz tanımını açıklayınız.
Lewis ortaklanmamış elektron çiftini vurgulayan asit-baz tanımını önermiştir. Bu tanıma göre, elektron çifti alan madde Lewis asidi, elektron çifti veren madde Lewis bazı olarak tanımlanır. Bu nedenle Lewis tanımlamasında asit olarak ele alınabilen türlerin sayısı artar.
Suyun asit-baz özelliği nasıldır?
Su amfiprotik özelliğinden dolayı bir asit varlığında proton alıcı olarak davranırken, bir baz varlığında proton verici olarak davranır. Su molekülünün başka bir su molekülü ile tepkimesi sonucu hidronyum (H3O+) ve hidroksit (OH–) iyonları oluşur (otoprotoliz) ve bu tepkimede proton alışverişi gerçekleştiğinden su çok az da olsa elektriği iletir.
Asitlik ve bazlığa göre pH skalası nasıl değişir?
Nötral sulu çözeltide, pH=pOH=7’dir. Asidik çözeltide pH<7, bazik çözeltide ise pH>7’dir.
HClO2 asidinin suyla reaksiyonu için konjuge asit baz çiftlerini gösteriniz.
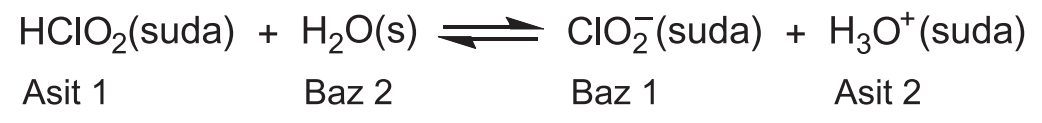
HClO2/ClO2 ve H3O+/H2O konjuge asit-baz çiftleridir.
Amfoter bileşiklerin davranışları nasıldır?
Bir bileşik farklı bileşiklere karşı hem asit hem de baz gibi davranabiliyorsa amfoter (amfiprotik) bileşik
olarak adlandırılır.
Lewis asidi ve Lewis bazı bileşiklerini tanımlayınız.
Yapısında elektron boşluğu bulunduran bileşikler (BF3, AlCl3 ve SO3 gibi) Lewis asidi olarak ve ortaklanmamış elektron çifti içeren bileşikler Lewis bazı olarak ele alınırlar.
Periyodik çizelgeye göre asitlik bazlık nasıl değişir?
Periyodik çizelgede aynı periyotta yer alan elementlerin hidrojenli bileşikleri için asitlik kuvveti, genel olarak periyotta soldan sağa doğru gidildikçe elektronegativitedeki artışa bağlı olarak artar. Periyodik çizelgede aynı grupta yer alan elementlerin hidrojenli bileşiklerinde asitlik kuvveti, merkez atomun büyüklüğü arttıkça artar.
Oksiasitlerin asitliliği nasıldır?
Asitlik kuvveti: Bir asidin asitlik kuvveti, merkez atom X’e elektronegatif atomlar bağlandığı zaman artar. H-O-X şeklinde gösterilen oksiasitler için asitlik kuvveti, X’in elektronegatifliğinin artması ile artar.
HOCl, HClO2, HClO3 ve HClO4 bileşiklerinin asitlik kuvvetleri nasıldır?
HClO4>HClO3>HClO2>HOCl sırasında asitlik kuvveti merkez atomun yükseltgenme basamağı sayısı, formal yükü ve O atomu sayısı arttıkça artar.
Otoprotoliz nedir?
Su molekülünün başka bir su molekülü ile hidronyum ve hidroksit iyonu oluşturduğu tepkimeye, suyun kendi kendine iyonlaşması otoprotoliz denir.
Hangi tip hesaplamalarda suyun iyonlaşması ihmal edilmez?
Kuvvetli asit ve kuvvetli bazların çok seyreltik çözeltilerinin ve zayıf asit baz çözeltilerinin pH’sı hesaplanırken suyun iyonlaşmasından gelen hidronyum veya hidroksit iyonlarının derişiminin ihmâl edilmez.
Asitlik ve bazlık sabitleri ile asitlik bazlık kuvveti nasıl değişir?
Asitlik veya bazlık sabitlerinin –logaritması alındığında pKa veya pKb değerleri elde edilir. pKa değeri küçüldükçe asit daha kuvvetli, pKb değeri küçüldükçe baz daha kuvvetli olur.
Nötralleşme tepkimelerini açıklayınız.
Asit çözeltileri ile baz çözeltileri karıştırılırsa, asit ve baz arasında gerçekleşen tepkime nedeniyle tuz ve su oluşur. Asit ve bazın eşdeğer miktarlarının kullanılmasıyla nötralleşme tepkimesi meydana gelir.
Nötralleşme titrasyonlarında seçilecek olan indikatör nasıl olmalıdır?
Bir titrasyonda indikatör seçimi önemlidir ve indikatörün renk değiştirdiği pH aralığının, nötralleşmenin
olduğu andaki pH değerine uygun olması gerekir.
Tuz nedir?
Bir asitle bir bazın tepkimeye girmesi sonucunda meydana gelen maddeye tuz denir. Böylece tuz asitten gelen negatif yüklü iyon ile bazdan gelen pozitif yüklü iyonun birleşmesinden meydana gelir.
Tuzların elektriksel kabileyetleri nasıldır?
Tuzlar iyonik yapılı bileşiklerdir. Suda iyonları hâlinde çözündükleri için elektriği iletirler yani kuvvetli elektrolittirler.
Tampon çözelti nedir?
tuzundan veya bir zayıf baz ve tuzundan oluşur. Bu çözeltiye belli miktara kadar asit veya baz eklendiğinde, çözeltinin pH değeri değişmez. pH değişimine karşı direnç gösteren çözeltilere tampon çözeltiler denir.
Biyolojik tampon sistemleri nelerdir?
Vücutta asit-baz dengesinin sağlanmasında etkili başlıca dört tampon sistemi vardır. Bunlar karbonik asit/bikarbonat, hidrojenfosfat/dihidrojen fosfat, asit protein/proteinat ve asit hemoglobin/hemoglobinat tampon sistemleridir.