Kimyasal Denge
Elektrolit nedir?
Sulu çözeltide elektriği iletebilen maddeler elektrolit, elektriği iletmeyen ve iyon içermeyen maddeler ise elektrolit olmayan şeklinde adlandırılırlar. Örneğin; sodyum klorür (NaCl) ve potasyum nitrat (KNO3) suda iyonlarına ayrıştığı için elektrolittir.
Kuvvetli ve zayıf elektrolit tanımlarını açıklayınız.
Elektrolitler kendi aralarında kuvvetli ve zayıf elektrolitler olmak üzere ikiye ayrılırlar. Çözeltisinde çözünenin tamamen (%100) iyonları halinde bulunduğu elektrolitler kuvvetli elektrolitler, çözünen maddenin tamamen değil de kısmen iyonları halinde bulunduğu elektrolit maddeler ise zayıf elektrolitler olarak tanımlanırlar. Örneğin; sodyum klorür (NaCl) ve potasyum nitrat (KNO3) gibi iyonik bileşikler, hidroklorik asit (HCl), nitrik asit (HNO3), perklorik asit (HClO4) gibi kuvvetli asitler ve sodyum hidroksit (NaOH) ve baryum hidroksit (Ba(OH)2) gibi kuvvetli bazlar birer kuvvetli elektrolittirler. Asetik asit (CH3COOH), nitröz asit (HNO2) ve amonyak (NH3) gibi bileşikler sulu çözeltide aşağıda gösterildiği gibi iyonlarına ayrılırlar. Suda tamamen iyonlaşmadıkları için de bu tür bileşikler zayıf elektrolitler olarak bilinirler.
Sulu çözelti tepkime türleri nelerdir?
Sulu çözeltilerde; çöktürme, nötralleşme ve yükseltgenme-indirgenme tepkimeleri olmak üzere üç tür tepkime gerçekleşir.
Kimyasal dengeyi açıklayınız.
Tepkimenin başlangıcında tepkime, ürün oluşturma yönünde ilerler ve ürün oluştukça ters yöndeki süreç yani tepkenler yönünde ilerleme de gerçekleşir ve sonuçta öyle bir ana gelinir ki ürünlerin ve tepkenlerin derişimleri artık değişmez, sabit kalır ve bu durumda ileri yöndeki tepkime hızı, geri yöndeki tepkime hızına eşit olur, yani kimyasal olarak dengeye ulaşılır. Kimyasal denge, dinamik bir süreçtir.
Denge sabiti nedir?
Kimyasal dengeyi nicel olarak belirleyen ve kapasite özelliği gösteren büyüklüğe denge sabiti adı verilir.
Tersini tepkime nedir?
Denge sabiti çok büyük olan tepkimeler ileriye doğru tek yönlü, çok küçük olanlar ise geriye doğru tek yönlü olarak gerçekleşir. Bunun yanında denge sabiti orta büyüklükte olan tepkimeler ise tersinir tepkimeler olarak adlandırılır. Denge sabiti sadece sıcaklıkla değişir ve ayrıca sıcaklıkla denge bileşimi de değişir.
2SO3(g)  2SO2(g) + O2(g) denkleminde denge sabiti (K) nasıl hesaplanır?
2SO2(g) + O2(g) denkleminde denge sabiti (K) nasıl hesaplanır?
K=[SO2]2[O2]/[SO3]2
şeklinde hesaplanır.
PCl5(g)  PCl3(g) + Cl2(g)
PCl3(g) + Cl2(g)
Denkleminde 450 oC Kc=0.040 olduğuna aynı sıcaklıktaki Kp değeri kaçtır?
Kp = KC(RT)∆n
Kp = 0.040 (0.082x723)1
Kp =2.371
Tepkime oranı (Q) ile denge sabiti (K) arasındaki ilişki nasıldır?
Q>K ⇒ Ürünlerin derişimleri dengedekilerden daha yüksektir. Bu durumda tepkime ters yönde, tepkenlere doğru ilerleme eğilimindedir.
Q<K ⇒ Tepkime ileri doğru ilerler ve ürün(ler) oluşturma eğilimindedir.
Q=K ⇒ Karışım dengededir ve her iki yönde de değişim için bir eğilimi yoktur.
Le Chatelier Kuralını açıklayınız.
Bu kurala göre; dengedeki bir sisteme dışarıdan bir etki yapıldığında, sistem bu etkiyi azaltacak yöne kendiliğinden kayar ve yeni bir denge oluşur. Deneysel olarak denetlenebilen değişkenler; derişim, basınç, hacim ve sıcaklıktır.
Derişim, basınç ve hacim değişkenlerinin değiştirilmesi sadece denge bileşiminde değişikliğe yol açarken, sıcaklığın değiştirilmesi hem denge bileşiminin hem de denge sabitinin değişimine neden olur. Basınç, hacim ve derişim değişimleri denge sabitini değiştirmez.
Katalizör nedir?
Katalizör, tersinir tepkimelerde katalizörün bulunmadığı duruma göre, daha hızlı dengeye ulaşılmasını sağlayan, yani katalizör tersinir tepkimelerde dengeye ulaşıllma sürecini hızlandırmaya yarayan kimyasal maddedir.
Arrhenius asit-baz tanımını yapınız.
Arrhenius tanımına göre, bir asit sulu çözeltiye hidronyum iyonu (H3O+) veren, bir baz ise sulu çözeltiye hidroksit iyonu (OH–) veren madde olarak tanımlanır.
HCl(sulu) + H2O(s) → H3O+ (sulu) + Cl–(sulu)
NaOH(k) → Na+(sulu) + OH–(sulu)
Brønsted-Lowry asit-baz tanımlarını açıklayınız.
Arrhenius asit-baz tanımı sadece sulu çözeltiler ve ortama H+ (H3O+)veya OH- veren maddeler için geçerli olduğundan oldukça sınırlı bir tanımdır. Asit ve bazlarla ilgili daha detaylı bir tanım Brønsted-Lowry tanımı olarak bilinir. Bu tanıma göre; bir asit, proton veya protonlar verebilen bir madde, bir baz ise proton(lar) alan bir madde olarak tanımlanır. Örneğin; HNO2 suda çözündüğünde;
HNO2 + H2O  H3O+ + NO2−
H3O+ + NO2−
Asit Baz Asit Baz
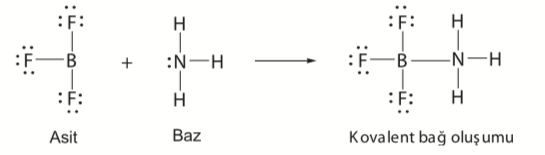
Lewis asit-baz tanımlarını açıklayınız.
Arrhenius asit-baz tanımı sadece sulu çözeltide geçerli, Brønsted-Lowry tanımında ise sadece proton aktarılması söz konusudur. Bununla birlikte bilinen pek çok tepkime Brønsted-Lowry tanımına uymaz. Bu nedenle yeni bir asit-baz tanımının yapılması gereği ortaya çıkmıştır. Lewis asit-baz tanımına göre; bir asit, bir kovalent bağ oluşturmak için biz bazdan elektron çifti alan bir bileşik, bir baz ise ortaklanmamış elektron çifti veren bir bileşik olarak tanımlanır. Örneğin; amonyak (NH3) bazı, bor triflorür (BF3) asidi ile tepkimeye girerek Lewis tanımı gereği bir asit-baz tepkimesi gerçekleştirir.
HBr, HCl, HF, HI bileşiklerinin asitlik kuvvetlerine göre sıralayınız.
HI>HBr>HCl>HF şeklinde sıralanmaktadır. bunun sebebi ise; elektro negativite olarak değerlendirildiğinde tam tersi olması beklenen sıralama halojenlerin atom çapının devreye girmesiyle elektronegativitenin etkisi azalamakta ve sıralama belirtildiği gibi olmaktadır.
Amfiprotik madde nedir?
Su (H2O) molekülü, bir asit molekülünden bir proton alarak H3O+ iyonunu oluşturur. Bu durumda su proton aldığı için bir bazdır. Su molekülü aynı zamanda, bir baza proton vererek OH– iyonuna da dönüşebilir, bu sonuca göre ise su bir asittir. Buna göre su molekülü hem proton vericisi hem de proton alıcısı olarak davranır ve bu özelliği gösteren maddelere amfiprotik maddeler denir.
Nötral, asidik ve bazik çözeltileri tanımlayınız.
[H3O+] derişiminin, [OH-] derişimine eşit olduğu sulu çözeltilere nötral çözelti denir. Asidik çözeltide [H3O+] derişimi [OH-] derişiminden büyüktür. Bazik çözeltide ise asidiğin tam tersi olarak [OH-] derişimi [H3O+] derişiminden büyüktür.
0.0025 M HCl çözeltisinin pH ve pOH değerlerini hesaplayınız.
HCl kuvvetli asittir ve suda tamamen iyonlaşır. dolayısıyla çözeltideki hidronyum iyonları HCl asitin iyonlaşmasından kaynaklı olur ve derişimi asidinkine eşittir.
pH= -log[H3O+] = - log(0.0025)=2.60
pOH + pH = 14
pOH= 11.4
0.02 M HA ve 0.01 M A- içeren çözeltinin pH değerini hesaplayınız. (HA bileşinin pKa değeri 5.0'dır)
HA  H++ A- Ka = 10-5 M
H++ A- Ka = 10-5 M
Başlangıç: 0.02 M - 0.01 M
Değişim: -X +X +X
Denge: 0.02-X X 0.01 + X
- Ka =
 =
=  = 10-5
= 10-5
x değeri 0.01 veya 0.02 yanında çok küçük bir değer olduğu için toplama ve çıkarma işlemindeki x değerinin katıkısı ihmal edilebilir ve böylece x=2 x 10-5 olarak bulunur.
pH=-log(2 x 10-5)=4.70
Titrasyon, indikatör, dönüm noktası terimlerini açıklayınız.
Standart bir baz (veya asit) çözeltisi genellikle, bir asit (veya baz) çözeltisinin derişiminin belirlenmesinde kullanılır ve bunun için yapılan işleme titrasyon adı verilir. Titrasyon işleminde erlene çoğunlukla bir asit-baz indikatörü (belirteç) eklenir. Eklenen standart maddenin, analit miktarına kimyasal olarak eşit olduğu nokta eşdeğerlik noktası, eşdeğerlik noktasında fiziksel bir değişimin gözlendiği nokta ise dönüm noktası olarak tanımlanır.