Termodinamik Temel Kavramlar
Termodinamiğin tanımı nedir?
Termodinamik enerji, enerji dönüşümleri ve özellikle ısı ve iş arasındaki etkileşimi inceleyen bilim dalıdır.
Sistem, çevre ve sistem sınırı kavramlarının tanımı nedir?
Sistem: Termodinamik açıdan incelenmek üzere seçilen kütle yada hacimdir.
Çevre: Sistemin dışında bulunan her şey çevre olarak adlandırılır.
Sistem sınırı: Sistemi çevresinden ayıran yüzeye sınır denir. Sistem sınırı gerçek veya hayali bir yüzeydir. Sistem sınırı sabit ya da hareketli olabilir. Matematiksel açıdan, sınırın kalınlığı sıfırdır, bu nedenle de kütlesi ve hacmi yoktur. Analize ve sisteme uygun olarak sistem sınırını biz çizeriz ve böylece analize başlamış oluruz. Çevre ve sistem arasındaki her türlü etkileşim sınır boyunca gerçekleşir.
Kapalı sistemlerin özellikleri nelerdir?
Kapalı sistem veya diğer adıyla kontrol kütlesi, sınırlarından kütle geçişi olmayan sistemdir. Kapalı sisteme kütle girişi veya çıkışı olamaz. Sabit bir kütle incelenmek isteniyorsa kapalı sistem seçimi uygundur. Kapalı sistem kısaca sistem yada kontrol kütlesi olarak adlandırılır. Seçilmiş sistemi belirmek için sınırın çizilmesi gerekir. Kapalı sistem sınırlarından enerji, iş veya ısı biçiminde geçebilir.
Açık sistemlerin özellikleri nelerdir?
Açık sistem veya diğer adıyla kontrol hacmi, uzayda belirlenen problemin çözümüne uygun bir şekilde seçilmiş bir hacmi temsil etmektedir. Kontrol hacmi genellikle kompresör, türbin, lüle gibi içinden akışkan akışı olan ekipmanların analizlerinde gereklidir. Bu ekipmanların içindeki akışların termodinamik analizinde, yaygın olarak ekipmanların fiziksel sınırları sistem sınırları olarak ele alınır. Kontrol hacimlerinin sınırlarını oluşturan kontrol yüzeylerinden kütle ve ısı geçişleri gerçekleşir.
Saf maddenin tanımı ve özellikleri nelerdir?
Sistem boyunca maddenin kimyasal bileşimi değişmiyor ve homojen kalıyorsa bu maddeye saf madde diyoruz. Bir saf madde katı, sıvı ve gaz fazlarında bulunabileceği gibi bu fazların karışımı olarak da bulunabilir. Birden fazla faz bir arada iken maddenin saf madde olup olamayacağına kolayca karar verebiliriz.
Doyma sıcaklığı ve doyma basıncının tanımı nedir?
Maddenin faz değiştirmesi sırasında özel hallerle karşılaşırız. Bir saf madde sabit basınç altında ısıtılarak buharlaştırılabilir yani sıvı fazdan gaz faza geçilir. Buharlaşmanın başladığı sıcaklık doyma sıcaklığı olarak adlandırılır. Doyma sıcaklığına karşı gelen basınç ise doyma basıncı olarak anılır. Doyma basınç ve sıcaklığındaki sıvı doymuş sıvı, buhar doymuş buhar olarak adlandırılır.
Termodinamikte özellikle kaç gruba ayrılır ve özellikleri nelerdir?
Termodinamikte özelikler iki ana grupta sınıflandırılmaktadır: bağımlı (yaygın, ekstensif) özelikler, bağımsız (yoğun, intensif) özelikler. Eğer bir özelik, sistemi oluşturan bütün parçaların değerlerinin toplamı sonucunda elde ediliyorsa bu bağımlı bir özeliktir. Diğer bir ifade ile sistemi oluşturan madde miktarına bağlı olan özelik bağımlı özeliktir. Örnek olarak hacim ve iç enerji sistemin kütlesine bağlı özeliklerdir. Eğer özelik madde miktarına bağlı değil ise bağımsız özelik olarak anılmaktadır. Örnek olarak sıcaklık, basınç ve yoğunluk verilebilir. Bağımlı bir özelik kütleye bölünerek bağımsız özelik olabilir. Örneğin hacim kütleye bölünerek özgül hacim elde edilir bu da bağımsız özeliktir.
Isıl denge, mekanik denge, kimyasal denge ve termodinamik dengenin tanımları nelerdir?
Isıl denge; sistemin her noktasında sıcaklığın aynı olması durumudur.
Mekanik denge; sistemin her noktasında basıncın aynı kalması durumudur.
Kimyasal denge; sistemin kimyasal bileşiminde bir değişiklik olmadığı durumdur.
Termodinamik denge; sistemin tüm denge hallerine sahip olduğu durumdur.
Özgül hacmin tanımı nedir?
Bir maddenin özgül hacmi birim kütlesinin hacmi olarak tanımlanır, birimi m3 /kg dır. Özgül hacim biriminden anlaşılacağı gibi yoğunluğun (kg/ m3) tersidir. Yoğunluk ve özgül hacim bağımsız (intensif) özeliklerdir.
Efektif basınç nedir?
Termodinamik analizlerde daha çok basıncın mutlak değeriyle ilgilenilir. Ancak basınç ölçen cihazlar daha çok atmosfer basıncından itibaren ölçüm yaptıkları için gösterdikleri değerler mutlak basınçla atmosfer basıncı arasındaki farktır. Bu fark efektif basınç olarak adlandırılır.
Enerji neyi kapsar ve hangi formülle ifade edilir?
Enerji doğada mekanik, elektrik, kimyasal, nükleer enerji gibi değişik biçimlerde bulunur. Sistemlerin sahip oldukları toplam enerji, bu enerjilerin tümünü kapsar ve E ile gösterilir. ![]() olarak ifade edilir.
olarak ifade edilir.
Sıfırıncı yasa nedir?
Termodinamiğin sıfırıncı yasası ısıl denge kavramından yararlanır. Yasaya göre iki ayrı cisim bir üçüncü cisim ile ısıl dengede ise cisimlerin de kendi aralarında ısıl dengede olacaklarını belirtmektedir. Bu yasa sıcaklık ölçümlerinin geçerliliği açısından gerekli bir yasadır.
Bir cismin sıcaklığı 30 °C artmaktadır. Bu artışı Kelvin (K) ölçeğine göre nasıl belirtiriz?
Soruda istenilen sıcaklık değişimidir. Bu Kelvin ve Celcius ölçeklerinde aynıdır, bu nedenle T (K) = 30'dur.
Sıcaklık ve ısı arasındaki farklılıklar nelerdir?
Sıcaklık bir özeliktir ve termometre ile ölçülür, moleküllerin ortalama kinetik enerjilerinin bir ölçüsüdür. Sıcaklık ölçüm birimleri; Celcius, Kelvin, Fahrenheit, Reamürdür. Isı yalnızca sıcaklık farkı olduğunda geçtiği bilinen bir enerjidir. Doğrudan ölçülemez, tesirlerinden hareketle hesaplanarak miktarı bulunur. Isı birimleri SI’da Joule (J) ve CGS birim sisteminde ise Calori (cal)’dir.
Termodinamiğin birinci yasası nedir?
Termodinamiğin birinci yasası, enerjinin niceliği ile ilgilidir. Birinci yasa, enerji miktarının korunduğunu, enerjinin yoktan var olmadığını ve vardan yok olamayacağını ifade eden bir korunum yasasıdır. Enerji kullanılmasında, bir işlem sırasındaki enerji alış verişlerinde, enerji miktarının bulunmasında uyulması gereken doğa prensibinin ifadesidir
Birinci yasanın an denklemi nasıl ifade edilir?
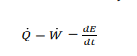
Birinci yasanın denge denklemi şekli nasıldır?
![]()
Isı kaynağı kavramının tanımı nedir?
Isı kaynağı: Isı çekildiğinde ya da ısı atıldığında sıcaklığı değişmeyen sonsuz kapasiteli kabul edilebilecek ısıl enerji deposudur. Sıcaklığı yüksek olan ısı kaynaklarına yüksek sıcaklıklı sıcak ısı kaynağı yada kısaca ısı kaynağı denir. Düşük sıcaklıktaki ve ısıl enerjinin atıldığı kaynak ise soğuk ısı kaynağı ya da ısıl enerji kuyusu diye adlandırılır.
Termodinamik çevrim, çalışan akışkan ve ısı makinesi kavramlarının tanımları nedir?
Termodinamik çevrim: Hal değişimlerinin peş peşe meydana gelerek yeniden başlangıç haline ulaşılmasıyla ortaya çıkan dönel hal değişimi.
Çalışan akışkan: Çevrim boyunca ısı geçişi olan ve hal değiştiren akışkana iş yapan akışkan ya da çalışan akışkan denir.
Isı makinesi : İş üreten makinedir.
Kelvin-Planck ifadesinin tanımı nedir?
Kelvin-Planck ifadesi: Isı makinelerinin dayandığı esası açıklayan ikinci yasa ifadesidir. Bir buhar güç santrali bir ısı makinesidir. Santralde, çalışan akışkan olan su, kazanlarda buharlaştırılır. Bu durum bir yakıtın yanmasıyla sağlanır ve “yüksek sıcaklık kaynağından ısı çekilmesi” anlamına gelir. Buhar türbinlere gönderilerek türbin kanatlarının dönmesi sağlanır, böylece jeneratörden elektrik enerjisi şeklinde iş üretilir. Türbinde basıncı ve sıcaklığı düşerek çıkan buhar, ilk haline dönmesi yani “sürekli iş üretmek” için yoğuşturuculara gönderilir. Bu “düşük sıcaklıktaki ısı kaynağına ısı atılması” demektir. Su yeniden buharlaşmak üzere kazana pompalarla basılır. Böylece, çalışan akışkan olan su termodinamik çevrimi tamamlamış olur.
Clausius ifadesinin açıklaması nedir?
Clausius ifadesi: “Isıyı bir düşük sıcaklık kaynağından yüksek sıcaklık kaynağına kendiliğinden aktaracak bir makine yapmak olanaksızdır.” Bu ifadede yer alan en önemli terim “kendiliğinden” kelimesidir. Burada kastedilen “çevrede hiçbir tesir bırakmayarak” işlemin meydana gelebilmesidir. Eğer ısı aktarımını dışarıdan iş vererek sağlayacak lursak çevrede değişiklik yapılmış olur. Clausius ifadesi iki ısı kaynağının olduğunu belirtir.